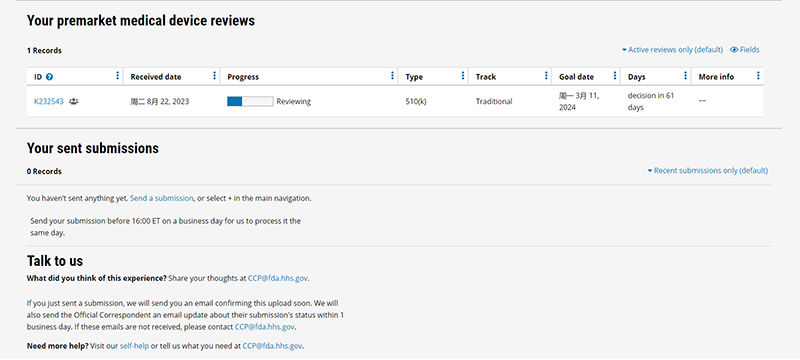
重大进展 近日,永利澳门6774cm的间充质干细胞无血清培养套装在美国FDA 510(k)二类医疗器械注册中取得重大进展。永利澳门6774cm于2019年首次向FDA递交该项申请并获得受理,510(k)号K190983,历时五年,正式进入SE评审阶段。若后续评审进展顺利,则正式进入签发评审阶段,理论上永利澳门6774cm间充质干细胞无血清培养套装将于2024年获得美国FDA 510(k)二类医疗器械注册证。 1、什么是FDA 510(k)? FDA 510(k)申请又叫上市前通报 (Premarket Notification),是FDA针对中度风险的医疗器械(大多数是二类产品)的一个注册审批程序。 在510(k)二类医疗器械注册过程中,企业向FDA递交上市前申请文件,包括产品的设计和性能,证明申请上市的器械与已经在市场上的器械在安全性和有效性方面的比较是实质等同的(substantially equivalent)。其中关键一步是申请者把申请上市的器械与现在美国市场上一种或多种合法器械进行技术对比,证明新申请上市的器械和市场上现有的产品实质等同。 FDA对Class II 医疗器械的定义:一般的控制不足以对器械安全性和有效性提供合理保障的器械。简而言之为风险等级较高的产品。 2、为何永利澳门6774cm申请510(k)耗时长久? 永利澳门6774cm从2019年开始申请FDA 510(k),之所以耗时长久,主要原因有两个: ①永利澳门6774cm提交的510(k)注册申请是美国FDA首次接受中国培养基产品申请受理,甚至是同类型产品的首次申请受理,审核流程尚在不断完善中,因此永利澳门6774cm与美国FDA共同沟通推进,耗费了大量的时间; ②在美国,FDA明确允许上市的间充质干细胞培养基培养出的干细胞,可以直接用于人体回输,因此美国为了保证从外国进口的产品安全,对于产品的验评非常严格,需要通过多项技术审核。 3、永利澳门6774cm申请510(k)都提交了哪些产品检测报告? 永利澳门6774cm从2019年提交间充质干细胞无血清培养基的510(k)申请,5年期间向FDA提交了包括培养基试剂瓶瓶体老化检测、体外细胞毒性试验、洗脱试验、无菌检测、内毒素的光度定量检测、急性全身毒性试验、包装密封性、基础培养基和添加剂的可浸出性分析等几十项干细胞培养基相关检测报告。永利澳门6774cm的间充质干细胞无血清培养基均通过了以上技术检测。 干细胞培养基相关检测报告 4、永利澳门6774cm申请510(k)的过程中都遇到了哪些困难? 永利澳门6774cm在申请510(k)的过程遇到了大量困难。2019年,永利澳门6774cm向FDA递交了510(k)报告需要准备的大量资料,FDA在收到永利澳门6774cm递交的510(k)资料后,确认受理后,同时给出申请受理编号(K190983)。 在RTA审查后,永利澳门6774cm提交的大部分产品检测报告均通过了FDA审核,但FDA认可的关于产品包装气密性检测的标准ASTM D3078标准并不适用于永利澳门6774cm产品,需要重新探索解决。 在随后长达两年多的时间里,永利澳门6774cm一直积极与FDA审查人员进行沟通,寻找适用于永利澳门6774cm无血清培养基包装形式的国际检测标准。2020年2月,FDA建议我们使用ASTM F2096气泡泄漏测试来评估包装完整性。但是,经过反复确认,这种测试方法仍然不适用于我们的产品。 直到2021年,我们和FDA经过多次沟通后,确定可以采用ASTM F2338-09测试方法来评估包装气密性。按照新的测试方法,永利澳门6774cm重新进行了包装气密性测试。随后我们重新提交了一份新的510(k)文件,编号为K213249,此号码也将作为正式批准后的号码。 5、永利澳门6774cm目前的510(k)申请进展如何? 为了保证进入美国的医疗器械的安全性,FDA 510(k)的评审十分严格,任何一个环节出现问题都有可能影响最终的评审结果。永利澳门6774cm目前已经通过了评审最为严格的接受性评审(RTA评审),即将进入实质等同性审查(SE评审)阶段。 永利澳门6774cm的产品经过严格的技术检测、拥有众多客户的大力支持,我们有信心通过接下来的评审。若进展顺利,永利澳门6774cm的间充质干细胞无血清培养基将进入510(k)二类医疗器械注册证签发批准阶段。届时,永利澳门6774cm的间充质干细胞无血清培养基不但是国内首款获得美国FDA 510(k)注册受理产品,又将是第一款获得美国FDA二类医疗器械注册证的产品。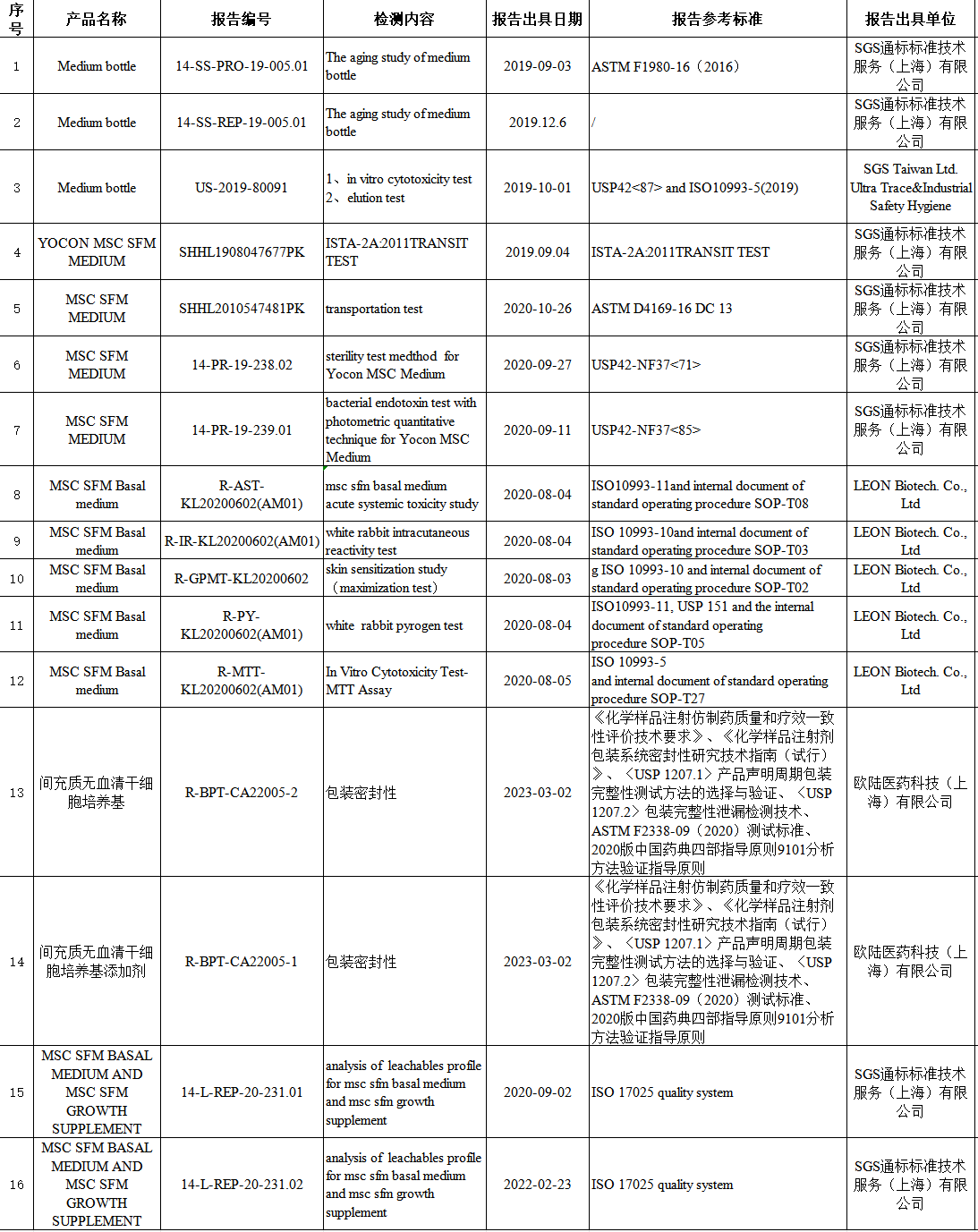
重大进展——永利澳门6774cm间充质干细胞无血清培养基FDA 510(k)正式进入SE评审
 永利澳门6774cm
永利澳门6774cm
 2024-02-06
2024-02-06
 公司热点
公司热点





